来自合作者南方医科大学周宏伟教授团队的研究发现,高达50%-70%的肝硬化患者会发展为肝性脑病(HE),这与肠道微生物群失调密切相关,但机制尚不清楚。通过构建肠-脑菌群模块评估宏基因组学数据集中的细菌神经毒素,发现主要来自瘤胃球菌属的苯丙氨酸脱羧酶(PDC)基因在肝硬化患者中增加了约10倍,在肝性脑病(HE)患者中更高(图1)。肝硬化小鼠(而非健康小鼠)在定植了活泼瘤胃球菌后,会出现脑部苯乙胺(PEA)蓄积,并伴有记忆障碍、对称性震颤和皮层特异性神经元缺失等典型的HE症状。PEA的积累主要是由于肝硬化导致肝脏和血清中的单胺氧化酶B活性降低。
为深度解析R. gnavus苯丙氨酸脱羧酶与HE的因果联系。中心谭扬副研究员构建了R. gnavus细菌的遗传转化体系并实现了PDC的靶向敲除,发现苯丙氨酸脱羧酶基因突变株失去转化苯丙氨酸为PEA的能力。将突变株定植于肝硬化的小鼠中,发现小鼠粪便、血液与大脑中的PEA浓度显著减少,并逆转了活泼瘤胃球菌诱发的神经中毒症状(图2)。以上揭示了肝性脑病的肠-脑轴新机制,表明活泼瘤胃球菌可通过苯丙氨酸脱羧酶及其代谢产物苯乙胺驱动肝性脑病,为肝性-脑病提供了潜在诊疗靶点。相关研究发表Nature Medicine (https://www.nature.com/articles/s41591-024-03405-9), 谭扬副研究员为该论文的并列第一作者,李福利研究员为共同作者。
肠道微生物能够代谢宿主摄入的外源性分子,同时自生也可合成内源性分子,这些代谢产物分子参与人类重要的生理过程。基因组编辑工具的缺乏,限制了对这些重要生理过程的内在分子机制研究,以及更高层面微生物组-宿主相互作用机制解析和人们基于此相互作用关系对微生物组的理性干预。开发肠道非模式细菌的基因编辑工具,将为深度解析微生物组-宿主间的相互作用机制,实现微生物组的理性干预,提供强大的使能工具。
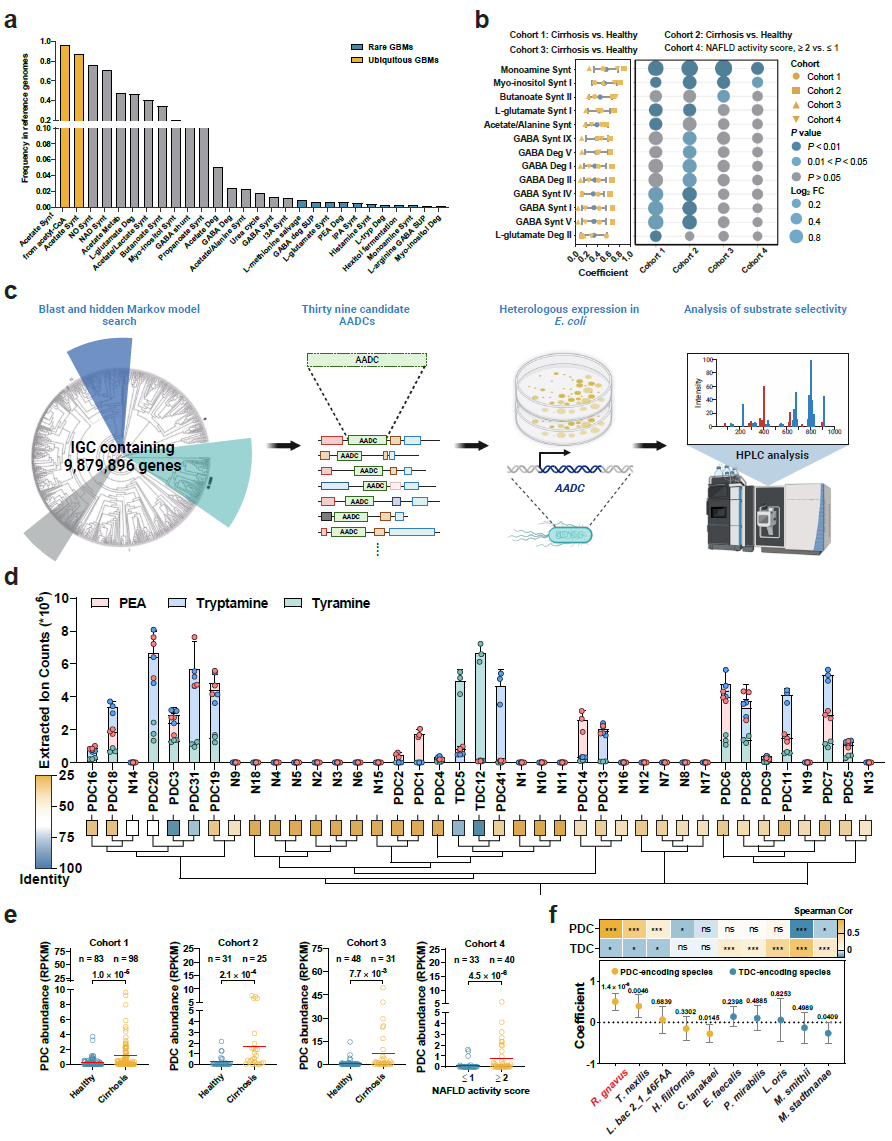
图1 来自R. gnavus的PDC基因丰度在各国的肝硬化患者中增加
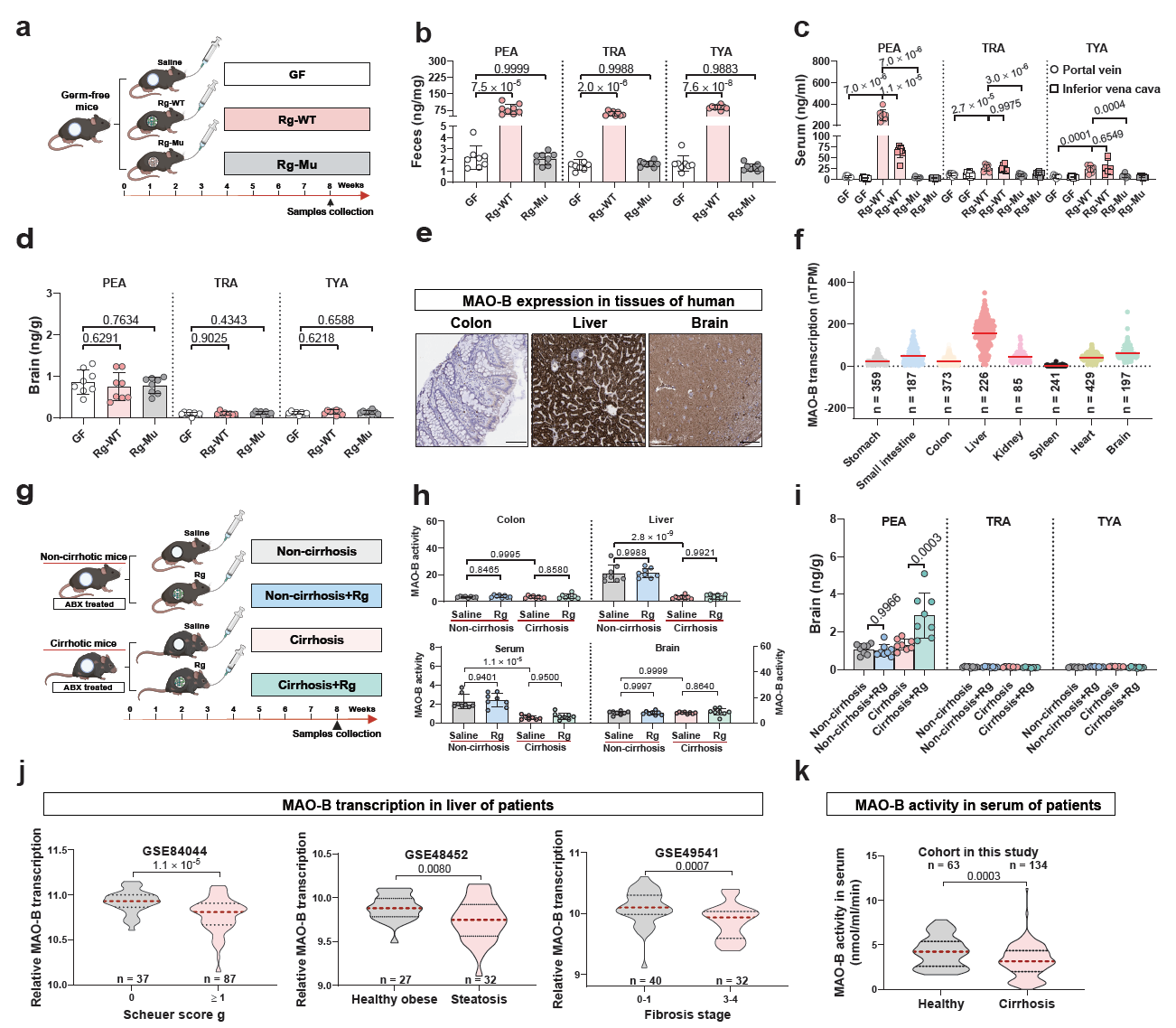
图2 由于肝硬化导致MAO-B活性降低时,R. gnavus合成的PEA在大脑中会呈现病理性积累